
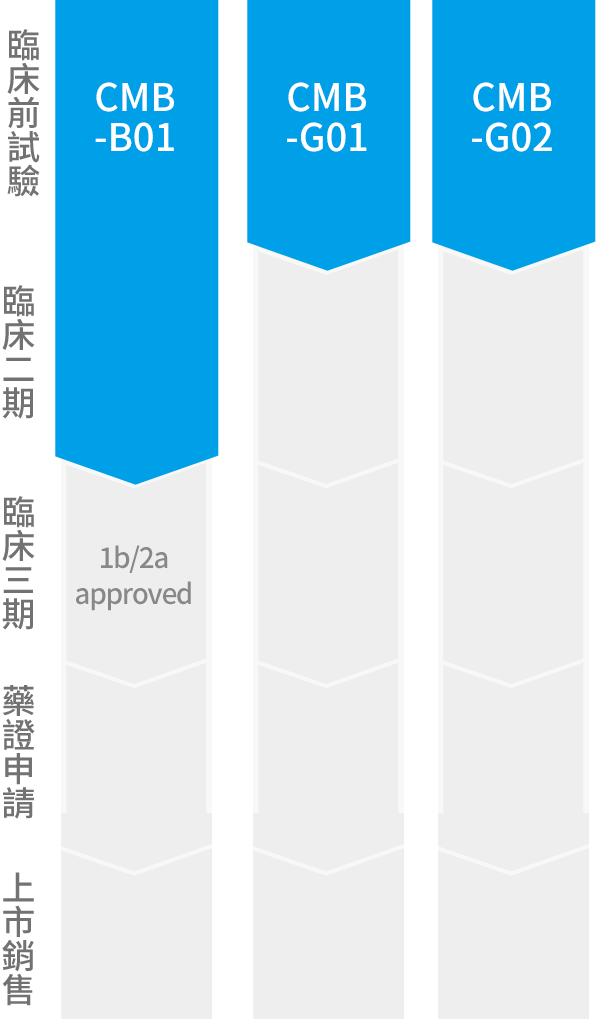

本案出自中央研究院的抗癌研究發現,經過財團法人生物技術開發中心的製造與品管技術開發,形成一用於治療惡性黑色素細胞癌的臨床新藥,已於2017年3月通過美國食品藥物管理局的審查(案號IND 133599),核准進行人體臨床試驗,將申請我國衛生福利部的許可,在台灣進行本藥物的安全劑量與有效劑量探索。臨床前動物實驗支持本新藥具有抑制腫瘤生長與轉移的功能,並且有助於降低化療毒性副作用,希望通過臨床試驗的驗證,能帶給患者另一個抗癌治療的新選擇。
黑色素細胞瘤是現今致死率最高的皮膚癌,因此又稱為惡性黑色素瘤,目前仍屬於預後相對不樂觀的癌症之一。
1. 抑制免疫正常小鼠體內黑色素瘤細胞生長。
2.透過抑制iNOS顯著抑制LPS誘導的巨噬細胞產生NO,並阻斷NFkB活化而抑制COX2與PGE2生成及其活性表現。
3.在體外試驗中與5-FU或Epirubicin併用有協同加成效應。
美國FDA已核准(案號IND 133599),準備申請台灣臨床試驗許可。